Az Európai Parlament és a Tanács 2023. március 20-án megjelentette új (EU)2023/607 számú rendeletét (https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32023R0607), amelyben meghosszabbítja az MDR-ben előírt átmeneti időszakot.
Az új rendelethez megjelent az EU honlapján egy hivatalos kérdés-válasz dokumentum is: https://health.ec.europa.eu/system/files/2023-03/mdr_proposal_extension-q-n-a_0.pdf
Az MDR Amendment a Legacy, illetve az Upclassified (osztályt lépett) eszközökre érvényes.
Az alábbi táblázatban az OGYÉI által publikált (Forrás: 2023.02.07. GS1 MEFCS UDI munkacsoport ülés) új átmeneti időszakok láthatók az eszközök kockázati osztály besorolásuk szerint.

A táblázat kiegészítésre került az UDI kötelezettségekkel is. Az UDI határidőket hasonlóan kell értelmezni, mint az IVDR átmeneti idő hosszabbításánál is. Ez azt jelenti, hogy a gyártó MDR tanúsításra való felkészülés során már ki kell ossza az UDI azonosítókat. Attól függően, hogy mikortól lesz érvényes MDR tanúsítványa és eszerint kezdi meg az eszközök gyártását és forgalomba hozását, már kötelező lehet az UDI jelölés. Ezért a gyártónak már időben végig kell gondolnia a jelölés technológiai lehetőségeit, pl. milyen típusú adathordozót válasszon, közvetlenül jelöli az eszközt, címkével vagy az eszköz csomagolására nyomtatja az adathordozót.
Új eszközök esetében továbbra is a Rendeletben leírt határidők irányadók.
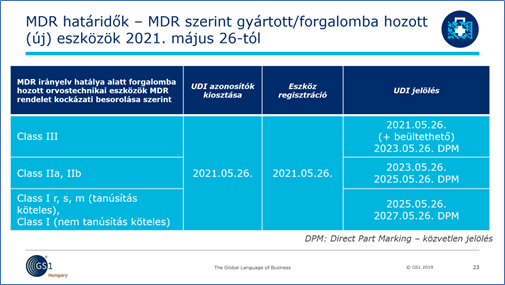
Fontos kiemelni, hogy a gyártóknak lehetősége van „idő előtt” az eszközazonosító (GTIN – UDI-DI) kiosztására, illetve a terméken történő jelölésre is.
UDI azonosítási, illetve jelölési kérdések, szakmai felkészüléshez keresse kollégánkat, Horváth-Hankó Christine-t az udi@gs1hu.org email címen vagy +36-30/162-6782 telefonszámon.
