Az Európai Tanács május végén elfogadta az Európai Bizottság idén januárban tett javaslatát. A javaslat részeként az IVDR rendelet átmeneti időszaka a legacy eszközök esetében meghosszabbításra kerül, de az eszközöknek a szabályozásban meghatározott feltételeknek eleget kell tenniük. Az új rendelet az orvostechnikai eszközök európai adatbázisának (EUDAMED) fokozatos bevezetését is lehetővé teszi.
Az elfogadott rendelet az EU Hivatalos Lapjában való közzétételt követően lép hatályba, amely a mai napon, 2024. július 9-én megtörtént.
„Azon eszközök, amelyek esetében a 98/79/EK irányelv szerinti megfelelőségértékelési eljárásba nem kellett bejelentett szervezetet bevonni, amelyek esetében a megfelelőségi nyilatkozatot az említett irányelvvel összhangban 2022. május 26. előtt állították ki, és amelyek esetében az e rendelet szerinti megfelelőségértékelési eljáráshoz bejelentett szervezet bevonása szükséges, a következő időpontokig hozhatók forgalomba, illetve vehetők használatba:
a) 2027. december 31-ig a D. osztályba sorolt eszközök esetében;
b) 2028. december 31-ig a C. osztályba sorolt eszközök esetében;
c) 2029. december 31-ig a B. osztályba sorolt eszközök esetében és az A. osztály”
Az új rendelet az orvostechnikai eszközök európai adatbázisának (EUDAMED) fokozatos bevezetését is lehetővé teszi, ahelyett, hogy kitolná az Eudamed kötelező használatát addig, amíg mind a hat modul el nem készül.
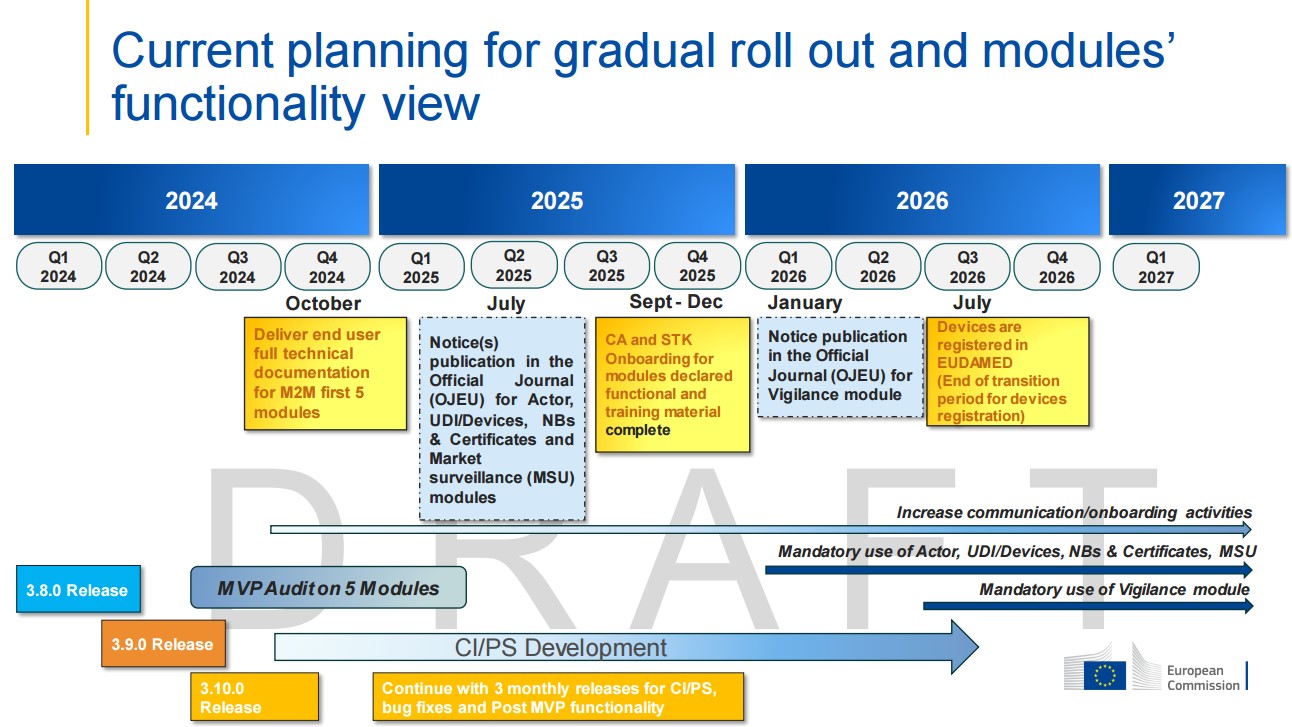
Az orvostechnikai eszközök UDI regisztrációs kötelezősége 2025. év végén már életbe is léphet, ha még idén az UDI modul validálásra kerül.
Bővebb információért csatlakozzon Ön is az online MEFCS UDI munkacsoport üléseihez!
Magyar GS1 Egészségügyi Felhasználói Csoport (MEFCS) regisztráció: https://gs1hu.org/mefcs
