November 27-én az Európai Bizottság hivatalos közleményt tett közzé az Európai Unió Hivatalos Lapjában (OJEU), amelyben megerősíti, hogy a négy EUDAMED modul teljes funkcionalitással rendelkezik és készen áll az éles használatra.
4 EUDAMED modul:
- Actor Registration – gazdasági szereplők modul
- UDI/Device – UDI és eszköz regisztrációs modul
- Notified Bodies & Certificates – bejelentett szervezet és tanúsítványok modul
- Market Surveillance – piacfelügyeleti modul
Ez a mérföldkő jelentős előrelépés az MDR és az IVDR teljes körű digitális támogatása felé, és egyúttal elindítja a hivatalos végrehajtási határidők számítását is.
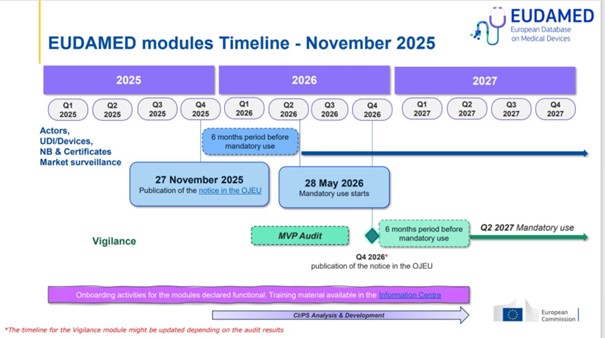
A főbb határidők az OJEU-közlemény alapján
2026. május 28. – kötelező indulás
Ettől a naptól kezdve kötelezővé válik a 4 EUDAMED modul alkalmazása.
2026. november 28. – az eszközregisztrációs átmeneti időszak vége
Eddig a dátumig minden olyan orvostechnikai eszközt regisztrálni kell az EUDAMED-ben, amelyet:
- a kötelezővé válás előtt már piacra helyeztek, és
- a kötelező indulás (2026. május 27.) után is forgalomban marad.
Bővebb információk a MEFCS UDI munkacsoport januári ülésén elérhetők, ahol az NNGYK képviselői segítik az EUDAMED 4 modul használatának követelményeinek megértését.
Ha még nem tagja a munkacsoportnak, regisztráljon a Magyar GS1 Egészségügyi Felhasználói Csoportba és jelentkezzen az UDI munkacsoportba: https://gs1hu.org/mefcs
Források:
- Az OJEU-közlemény: https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=OJ:L_202502371
- A frissített EUDAMED-idővonal: https://health.ec.europa.eu/document/download/04ce2012-97df-4dd0-8a39-d4f6993b9e16_en?filename=md_eudamed_roadmap_en.pdf
- Gradual Roll-Out EUDAMED Q&A: https://health.ec.europa.eu/document/download/0e7327c7-0e06-4fbd-90d3-8ab7bb30fe9f_en?filename=eudamed-qa_en.pdf
